"식약처, 렘데시비르 국내 임상3상 부작용 발생 알고도 조건부 허가"
이미지 확대 보기
AD
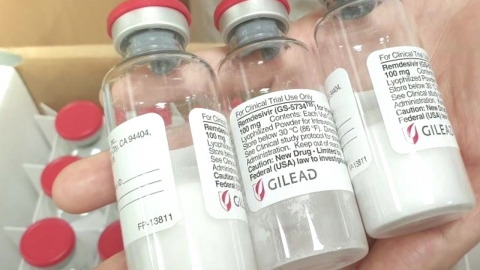
식품의약품안전처가 코로나19 치료제 렘데시비르의 부작용을 알고도 치료제로 조건부 허가했다는 의혹이 제기됐습니다.
국회 보건복지위원회 소속 국민의힘 강기윤 의원이 식약처에서 받은 자료에 따르면 식약처는 서울의료원에서 3월 27일부터 6월 25일까지 실시한 렘데시비르 임상 3상에서 심박수 감소 부작용 1건을 지난 4월 보고받았지만 7월 24일 치료제로 사용하도록 허가했습니다.
국내 렘데시비르 허가는 조건부 허가인데 국제 임상 최종 결과와 추가 위해성 완화조치 등을 시판 후 제출하는 조건으로 내려집니다.
실제 투여 환자에게선 지난 8월 간 수치 상승, 피부 두드러기 발적, 심장 심실 조기 수축 등의 이상 반응이 확인됐습니다.
방역 당국에 따르면 이달 7일 기준 총 274명의 코로나19 환자가 렘데시비르를 투여받았으며 이들 가운데 16명이 사망한 것으로 알려졌습니다.
강기윤 의원은 "부작용이 없는 약은 없겠지만, 국내 임상에서 부작용이 발생했다면 코로나19로 전 국민이 엄중한 위기에 놓여 있는 현실을 고려해 사실을 투명하게 공개했어야 한다"고 말했습니다.
렘데시비르는 길리어드 사이언스에서 에볼라 치료제로 개발한 항바이러스제로 코로나19 환자의 회복 기간을 30%가량 줄이는 효과를 내 주목받았습니다.
※ '당신의 제보가 뉴스가 됩니다' YTN은 여러분의 소중한 제보를 기다립니다.
[카카오톡] YTN을 검색해 채널 추가 [전화] 02-398-8585 [메일] social@ytn.co.kr [온라인 제보] www.ytn.co.kr
국내 렘데시비르 허가는 조건부 허가인데 국제 임상 최종 결과와 추가 위해성 완화조치 등을 시판 후 제출하는 조건으로 내려집니다.
방역 당국에 따르면 이달 7일 기준 총 274명의 코로나19 환자가 렘데시비르를 투여받았으며 이들 가운데 16명이 사망한 것으로 알려졌습니다.
강기윤 의원은 "부작용이 없는 약은 없겠지만, 국내 임상에서 부작용이 발생했다면 코로나19로 전 국민이 엄중한 위기에 놓여 있는 현실을 고려해 사실을 투명하게 공개했어야 한다"고 말했습니다.
렘데시비르는 길리어드 사이언스에서 에볼라 치료제로 개발한 항바이러스제로 코로나19 환자의 회복 기간을 30%가량 줄이는 효과를 내 주목받았습니다.
※ '당신의 제보가 뉴스가 됩니다' YTN은 여러분의 소중한 제보를 기다립니다.
[카카오톡] YTN을 검색해 채널 추가 [전화] 02-398-8585 [메일] social@ytn.co.kr [온라인 제보] www.ytn.co.kr
[저작권자(c) YTN 무단전재, 재배포 및 AI 데이터 활용 금지]
AD
AD
많이 본 뉴스
- 1 '3년간 매달 10만 원씩 저축하면 720만 원'...내일부터 모집
- 2 전국노래자랑 진행자 김신영 → 남희석 교체 시청률은 하락 중
- 3 작곡가 유재환, 결혼 발표 후 성희롱 의혹…SNS 삭제하고 침묵
- 4 "사이코패스 진단 가장 높은 점수"...연쇄살인마 엄여인, 첫 얼굴 공개
- 5 "그만 찍어"...日 후지산 인스타 사진 명소 가림막 설치한다
- 6 호주 항공사, 갑작스러운 운영 중단 통보..공항 갇힌 승객들 '발 동동'
- 7 본회의장 도중 공개 구혼했던 시의원 결국 '결혼 성공'
- 8 차에 치여 죽어가는 유기견에 군복 덮어준 군인..."보살핌에 감사"
- 9 시흥 교량 공사현장 구조물 붕괴...1명 중상·6명 경상
- 10 "李, 한심한 정치" vs "尹, 우이독경"...'회담 후' 신경전





!["분하다"...이재명 살해 시도 60대가 남긴 쪽지 [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301930236810_k.jpg)
![불타는 \'해리포터 성\'..."러시아, 오데사에 집속탄" [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301757535286_k.jpg)
![연계 의혹 모락모락...한반도서 기습 가능성 제기 [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301729002108_k.jpg)
![대한극장, 66년 만에 문 닫는다...운영사가 밝힌 \'추후 계획\' [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301710357239_k.jpg)
![배달라이더 등 460만 명, 1조 350억 원 환급받는다 [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301546010205_k.jpg)
!["10만원 넣으면 정부가 10만원 더"...청년내일저축계좌, 신청 방법은? [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301546112854_k.jpg)
![中 \'사드 보복\' 방관하던 미국...동맹 지킬 칼 뽑았다 [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301449260773_k.jpg)
![\'인스타샷 성지\' 소문에 몸살...후지산 아래 마을 \'강경 조치\' [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301445471365_k.jpg)
!["제재 위반 가능성"...김정은 찬양 뮤비에서 딱 걸린 \'이것\' [지금이뉴스]](http://image.ytn.co.kr/general/jpg/2024/0430/202404301443004901_k.jpg)
![윤석열 대통령·이재명 대표, 첫 회담...\'김 여사 특검\'도 의제? [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0429/202404290924248063_h.jpg)
![또다른 \'경고음\' 울린 서민 경제..."우려 커지는 상황" [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0429/202404290808110576_h.jpg)
!["90년대 생도 희망퇴직 검토" 청년도 내모는 한전의 경영난? [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0426/202404260848294725_h.jpg)
!["尹-한동훈 갈등 심상치 않다"...총선 직전 무슨 일이? [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0425/202404251626052318_h.jpg)
![\'명심\' 전쟁 벌어진 국회의장직..."국회 격 떨어뜨리는 것" [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0424/202404241014186280_h.jpg)
![하이브 \'내홍\'...경영 방식에 따른 예견된 위기? [Y녹취록]](http://image.ytn.co.kr/general/jpg/2024/0424/202404240744305611_h.jpg)









